Model 111 MINI IEF快速操作指南
信息来源: 时间:2015-07-10 点击次数:
一.母溶液配置:
1. Monomer concentrate (T=25%, C=3%)
24.25% (w/v) acrylamide
0.75% (w/v) bis (N, N’-Methylene-bis-acrylamide)
24.25 g acrylamide 和0.75 g 溶于水, 定容至100 ml,过滤后储存 在 4°C.
2. 0.1% (w/v) riboflavin-5'-phosphate (FMN)
50 mg FMN溶于50 ml 水,避光存储于4 °C 。
3. 10% (w/v) 过硫酸氨
100 mg AP溶于1 ml water(新制)
4. 25% 甘油 (w/v)
Add 25 g glycerol to 50 ml H2O. Dilute to 100 ml with H20.
(25ml甘油溶于100ml水中)
5. TEMED (N,N’-tetramethylene-ethylenediamine)
二.实验溶液(1)
The following volumes will produce sufficient reagent for two 125 x 65 x 0.4 mm gels:
Monomer-ampholyte solution
水 5.5 ml
胶 (25% T, 3% C) 2.0 ml
25% (w/v)甘油 2.0 ml
两性电解质*Ampholyte 0.5 ml(浓度40%)
Catalyst solutions
10% (w/v) 过硫酸氨 15 µl
0.1% (w/v) FMN 50 µl
TEMED (neat) 3 µl
*Volume required for 40% ampholyte solutions (Bio-Lyte 3/10, 4/6, 5/7, 6/8, 7/9 ampholytes).
For 20% ampholyte (Bio-Lyte 3/5, 8/10 ampholytes) add 1 ml ampholyte and reduce H2O
volume to 5.0 ml.
实验溶液(2)
固定液(100ml):
4%三氯醋酸4ml,12.5%磺基水杨酸12.5ml,30%甲醇30ml
染色液(100ml)
27%乙醇 27ml,10%乙酸 10ml,0.04%考马斯亮蓝R-250 4mg,0.5%CuSO4 2.5g,
脱色液:
12%乙醇,7%乙酸,0.5%CuSO4,
三.实验过程
1.取一感光膜,在两面分别滴上一滴水,水滴扩散的为亲水面,反之为疏水面。
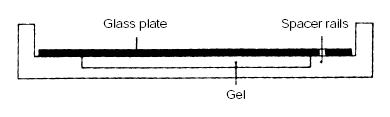
2.在玻板一面加水,而后将感光膜的疏水面与之紧密相贴,并按下图,将亲水面向下置于灌胶槽上。
3 对配好的实验溶液(1)抽真空15分钟
4.将2的玻板置于灌胶槽上,上倾30度,灌胶。在强光下凝胶1小时。
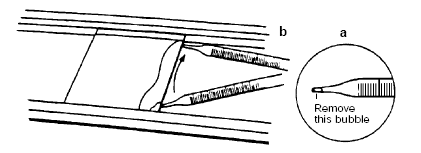
如果胶内有气泡,须轻轻敲击玻板,赶走气泡。
5 将凝好的胶和玻板撬出。
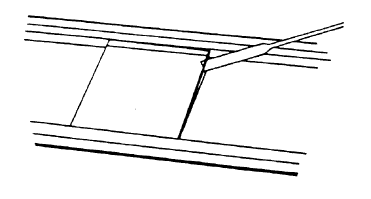
6 将胶-玻板,胶面朝上平置,在空气中干燥15-20分钟。
7 将点样梳齿平行置于胶上,而后点样。梳齿长轴与胶长轴平行。

8 每一点样孔加入2ml蛋白样品,加完样品后需等待5-7分钟。过多的未被胶吸收的样品,必须去掉。
9 将点好样的胶,置于电极上,开始电泳IEF。
10电泳完毕后把玻板取下,并将膜-胶取下,并将膜-胶放入固定液中固定45分钟。
11将固定好的膜-胶在染色液中染色3小时。
12将染好的膜-胶在脱色液中脱色3小时。





 川公网安备 51010702000030号
川公网安备 51010702000030号